Şema 1: Maddenin Ayırt Edici Özellikleri Şeması
Maddelerin ortak özellikleri olduğunu daha önceki yıllarda görmüştük. Tüm maddeler bu özelliklere sahiptir. Bu özellikler;
Bazı maddeler görünüş olarak birbirlerine o kadar çok benzer ki ayırt etmekte zorlanırız. Örneğin toz şekere, una ve tuza uzaktan baktığımızda aynı madde gibi algılayabiliriz ancak tatlarına baktığımızda farklı maddeler olduğunu anlarız.
Su, alkol ve eter gibi maddelerin de görünüşleri aynı olmasına rağmen kokuları farklı olduğundan onları ayırt edebiliriz. Peki, renkleri, büyüklükleri, sertlikleri, şekilleri gibi birçok özellikleri aynı olan maddeleri ayırt etmek için her zaman onların tadına bakabilir, koklayabilir veya onlara dokunabilir miyiz?
Birçok maddeyi koklamak, dokunmak ve tatmak çok tehlikelidir. Bunun yanı sıra bu özellikler maddeleri ayırt etmek için yeterli olmayabilir. Her maddenin kendine özgü özellikleri vardır, sadece bir maddeye özgü özellikler. Bir maddeyi diğer maddelerden ayıran bu özelliklere, maddenin ayırt edici özellikleri denir. Bunlardan bazıları; erime noktası, kaynama noktası ve donma noktasıdır. Maddelerin ayırt edici özellikleri saf maddeler için geçerlidir. Karışım hâlinde olan maddelerin ayırt edici özelliklerinden bahsedemeyiz. Maddelerin kendilerine özgü özelliklerini bilmemiz, maddeleri diğer maddelerden ayırt etmemizi sağlar.
Grafik 1: -10 °C’deki Saf Buzun Erime Grafiği
-10 °C'deki buz parçasını ısıttığımızda sıcaklık 0 °C'ye ulaştığında buz erimeye başlar. Buzun tamamı su oluncaya kadar sıcaklık 0 °C olarak kalır. Buzun tamamı eridikten sonra sıcaklık yükselmeye başlar.
DİKKAT!!!
Karışım hâlindeki sıvıların belli bir donma/erime noktası olmaz. Çünkü karışımlar saf madde değildir. Karışımlar hal değiştirirken de sıcaklıkları artmaya/azalmaya devam eder.
Sıvı haldeki saf bir madde ısı verdiğinde sıcaklığı düșebilir. Sıcaklık belirli bir değere düștüğünde madde donmaya bașlar. Sıvının donmaya bașladığı bu sıcaklık değerine donma noktası denir. Saf maddelerin donma noktaları birbirinden farklıdır. Bu yüzden erime noktası maddeler için ayırt edici özelliktir. Sıvı maddenin donmaya başladığı andan tamamı donana kadar sıcaklık sabit kalır. Saf su için donma noktası (sıcaklığı) 0 °C’tür.
DİKKAT!!!
Karışım hâlindeki sıvıların belli bir kaynama/yoğuşma noktası olmaz. Çünkü karışımlar saf madde değildir. Karışımlar hal değiştirirken de sıcaklıkları artmaya/azalmaya devam eder.
Grafik 2: 10 °C’deki Saf Suyun Donma Grafiği
+10 °C'deki suyu soğuttuğumuzda sıcaklık 0 °C'ye ulaştığında su donmaya başlar. Suyun tamamı buz oluncaya kadar sıcaklık 0 °C olarak kalır. Suyun tamamı donduktan sonra sıcaklık düşmeye devam eder.
Aynı saf madde için erime noktası (erime sıcaklığı), donma noktasına (donma sıcaklığı) eşittir.
Erime Noktası = Donma Noktası
Saf maddelerin erime ve donma noktası madde miktarına bağlı değildir. Maddenin miktarı erime ve donma noktalarını etkilemezken erime ve donma sürelerini değiștirir. Yani 1g buz da 0 °C’de donar 100g buz da 0 °C’da donar.
|
Saf Madde |
Erime - Donma Noktası (°C) |
Saf Madde |
Erime - Donma Noktası (°C) |
|
Bakır |
1083 |
Su |
0 |
|
Altın |
1064 |
Cıva |
-39 (Sıfırın altında) |
|
Alüminyum |
660 |
Etil Alkol |
-117 (Sıfırın altında) |
|
Kurşun |
327 |
Oksijen |
-218 (Sıfırın altında) |
Tablo 1: Bazı Saf Maddelerin Erime/Donma Noktaları
Tabloda verilen maddelerin erime ve donma noktalarını inceleyelim.
Saf sıvı maddeler ısı aldığında sıcaklık değeri artar. Bu sıcaklık artışı belli bir değere geldiğinde sıvı kaynamaya başlar. Sıvılar her sıcaklıkta buharlaşır ancak belirli sıcaklıklarda kaynar. Kaynama süresince sıcaklık sabit kalır.
✽✽ Saf sıvıların kaynamaya başladığı bu sıcaklığa kaynama noktası denir.
✽✽ Saf maddelerin tümünün kaynama sıcaklıkları farklıdır. Yani kaynama noktası saf sıvı maddeler için ayırt edici özelliktir.
Buharlaşma sıcaklığı (noktası), maddeler için ayırt edici bir özellik değildir. Buharlaşma her sıcaklıkta olur.
Saf maddelerin yoğuşma noktaları kaynama noktalarına eşittir. Saf su için bu değer 100 °C’dir.
|
Saf Madde |
Kaynama/Yoğuşma Noktası (°C) |
Saf Madde |
Kaynama/Yoğuşma Noktası (°C) |
|
Altın |
2836 |
Su |
100 |
|
Demir |
2750 |
Etil Alkol |
78 |
|
Alüminyum |
2450 |
Aseton |
56 |
|
Gümüş |
2162 |
Helyum |
-269 (Sıfırın altında) |
Tablo 2: Bazı Saf Maddelerin Kaynama/Yoğuşma Noktaları
Tabloda verilen saf maddelerin kaynama/yoğuşma sıcaklıklarını inceleyiniz.
Grafik 3: 40 °C’deki Saf Suyun Kaynama Grafiği
40 °C'deki suyu ısıttığımızda sıcaklık 100 °C'ye ulaştığında su kaynamaya başlar. Suyun tamamı su buharı (gaz) oluncaya kadar sıcaklık 100 °C olarak kalır. Suyun tamamı gaz hale geçtikten sonra sıcaklık yükselmeye başlar.
Grafik 4: 130 °C’deki Saf Su Buharının Yoğuşma Grafiği
120 °C'deki su buharını soğuttuğumuzda sıcaklık 100 °C'ye düştüğüne su buharı yoğuşmaya başlar. Su buharının tamamı su (sıvı) oluncaya kadar sıcaklık 100 °C olarak kalır. Su buharının tamamı sıvı hale geçtikten sonra sıcaklık düşmeye devam eder.
Kaynama Noktası = Yoğuşma Noktası
Saf maddelerin kaynama ve yoğuşma noktası madde miktarına bağlı değildir. Maddenin miktarı kaynama ve yoğuşma noktalarını etkilemezken kaynama ve yoğuşma sürelerini değiștirir. Yani 1g su da 100 °C’de kaynar 100g su da 100 °C’da kaynar.
Sonuç olarak, hâl değişimi süresince saf maddeler ısı almaya ya da vermeye devam etseler de sıcaklıkları değişmez. Hâl değişim sıcaklıkları olan kaynama ve donma noktası sıvılar, erime noktası da katı maddeler için ayırt edici bir özelliktir.
Hâl değişim sıcaklıklarının (erime-donma-kaynama-yoğuşma) saf maddeler için ayırt edici bir özellik olduğunu öğrendik. Peki, erime noktası, donma noktası ve kaynama noktası madde miktarına göre değişir mi?
Örneğin; 5g su 0 °C’de donarken 100g suyun donma sıcaklığı farklı mıdır? Ya da 50g su 100 °C’de kaynarken, 100g suyun kaynama sıcaklığı farklı mıdır?
Cevap; madde miktarı hâl değişim sıcaklıklarını etkilemez. Sadece ısınma ya da soğuma süresini değiştirir.
Bu cevabı aslında evde büyüklerimizin gözetiminde yapacağımız küçük bir etkinlikle görebilirz. Bir demlik, su, termometre, saat ve ocak ile bu etkinliği yapabiliriz. http://www.deneydefteri.com/deney-etkinlik/madde-miktari-hal-degisim-sicakliklarini-etkiler-mi-49 linkinden bu etkinliği yapabilirsiniz.
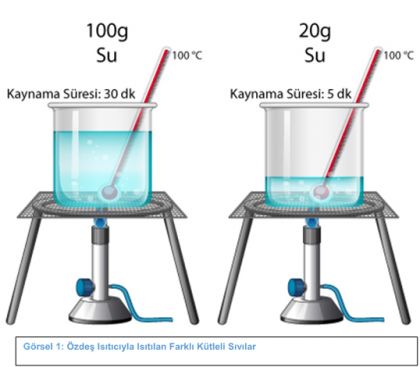
Görsel 1: Özdeş Isıtıcıyla Isıtılan Farklı Kütleli Sıvılar
Yukarıdaki görselde; 100g ve 20g suların özdeş ısıtıcılarda ısıtıldığında kaynama sıcaklığının değil sadece kaynama süresinin değiştiği görülmektedir.
Madde miktarı sadece hâl değişim süresini etkiler, hâl değişim sıcaklığını etkilemez…
Evde yapabileceğimiz küçük bir etkinlikle bunu gözlemleyebiliriz. Etkinliği http://www.deneydefteri.com/deney-etkinlik/isitici-sayisi-isiticinin-gucu-hal-degisim-sicakliklarini-etkiler-mi-50 linkinde görebilirsiniz.
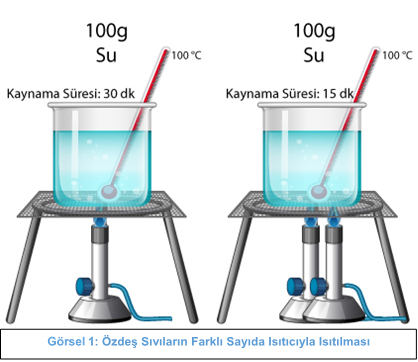
Görsel 2: Özdeş Sıvıların Farklı Sayıda Isıtıcıyla Isıtılması
Yukarıdaki görselde; 100g kütleli suların özdeş ve farklı sayıda ısıtıcılarda ısıtıldığında kaynama sıcaklığının değil sadece kaynama süresinin değiştiği görülmektedir. İki ısıtıcı ile ısıtılan beherdeki suyun daha kısa sürede kaynadığını görürüz.
Isıtıcının gücü sadece hâl değişim süresini etkiler, hâl değişim sıcaklığını etkilemez…
Aşağıdaki tablo 100g kütleli katı haldeki bir saf maddenin ısıtılırken kaydedilen sıcaklık ve zaman değerlerini göstermektedir.
|
Sıcaklık (°C) |
-20 |
0 |
0 |
20 |
40 |
60 |
80 |
100 |
100 |
|
Zaman (dk) |
0 |
5 |
10 |
15 |
20 |
25 |
30 |
35 |
40 |
Tablo 2: Bir Katının Zamana Bağlı Sıcaklık Değişimi Tablosu
Tabloya göre aşağıdaki soruları cevaplayalım:
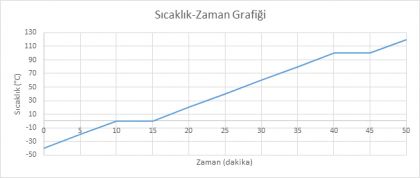
Grafik 5: Saf Bir Katı Maddenin Sıcaklık-Zaman Grafiği
Grafiği verilen madde ile ilgili;
|
Madde başlangıçta hangi fiziksel haldedir?
Maddenin erime sıcaklığı kaç °C’tur?
Madde 5.dakikada hangi fiziksel haldedir?
Madde 90 °C’ta hangi fiziksel haldedir?
Maddenin erimesi kaç dakika sürmüştür?
|
Maddenin kütlesi azalırsa erime sıcaklığı kaç °C olur?
Maddenin 46.dakikadaki fiziksel hali nedir?
Maddenin kaynama sıcaklığı kaç °C’tur?
|
|
Sıcaklık (°C) |
10 |
20 |
20 |
20 |
40 |
70 |
70 |
70 |
|
Zaman (dakika) |
0 |
5 |
10 |
15 |
20 |
25 |
30 |
35 |
Yukarıdaki tabloda bir maddenin zamana bağlı sıcaklık değerleri gösterilmiştir. Bu tablodan yararlanarak sıcaklık-zaman grafiğini çiziniz…
Grafik 6: Bir Katının Sıcaklık-Zaman Grafiği
Günlük hayatta maddelerin ayırt edici özelliklerinden birçok alanda faydalanılmaktadır. Karışımların ayrıştırılmasında, madencilikte minerallerin birbirinden ayrıştırılması, gıda laboratuvarlarında mineral madde tayinlerinin yapılması işlemlerinde sıkça ayırt edici özelliklerden faydalanılır.
Saf maddelerin sıcaklığı hâl değişim sürelerince sabit kalır. Örneğin; saf su 0 °C’de donmaya başlar. Soğutulan kapta bulunan suyun tamamı donana kadar ne kadar soğutursanız soğutun sıcaklık 0 °C’de kalır. Suyun tamamı donduktan sonra ancak sıcaklık düşmeye devam eder. Ya da tam tersi de geçerlidir. Erimekte olan saf buz erimeye başladığı andan tamamen eriyinceye kadar sıcaklığı 0 °C’de sabit kalır.
Saf maddeler içerisine başka maddeler katılarak, erime, donma, kaynama noktarları değiştirilebilir. Örneğin; kışın yolların tuzlanmasının sebebi suyun donma noktasını düşürmektir.
Faydalanılan Kaynaklar:


